Terapias CAR-T: Reprogramación del sistema inmunitario contra el cáncer
Antes de entrar en detalles técnicos, es importante comprender la idea general: Las terapias CAR-T convierten las defensas inmunitarias del propio paciente en un tratamiento personalizado contra el cáncer. Se extraen algunas de sus células T (los "soldados" del sistema inmunitario), se entrenan en el laboratorio añadiéndoles un "sensor" que reconoce con precisión las células tumorales y, una vez reintroducidas en el organismo, estas células modificadas buscan y destruyen esos objetivos.
Las terapias CAR-T (Chimeric Antigen Receptor T-cell) son una forma de inmunoterapia avanzada en la que los glóbulos blancos (células T) del propio paciente se modifican en el laboratorio para que expresen un receptor artificial (CAR) diseñado para reconocer y destruir células tumorales específicas.
En el proceso estándar, cada paciente se somete a aféresis para obtener leucocitos, se aíslan sus células T y se modifican genéticamente para que expresen un receptor de antígeno quimérico (CAR) dirigido contra un antígeno tumoral. El CAR combina la parte externa de un anticuerpo (que reconoce el antígeno de la célula cancerosa) con dominios internos de señalización de las células T (como CD3ζ y moléculas coestimuladoras como CD28 o 4-1BB). Esto permite a las células T "ver" antígenos cancerígenos que no estaban previamente programadas para detectar y, al unirse a ellos, activar y eliminar esas células malignas. Por último, tras una expansión masiva en cultivo, millones de células CAR-T modificadas se reinfunden en el paciente para atacar el tumor.
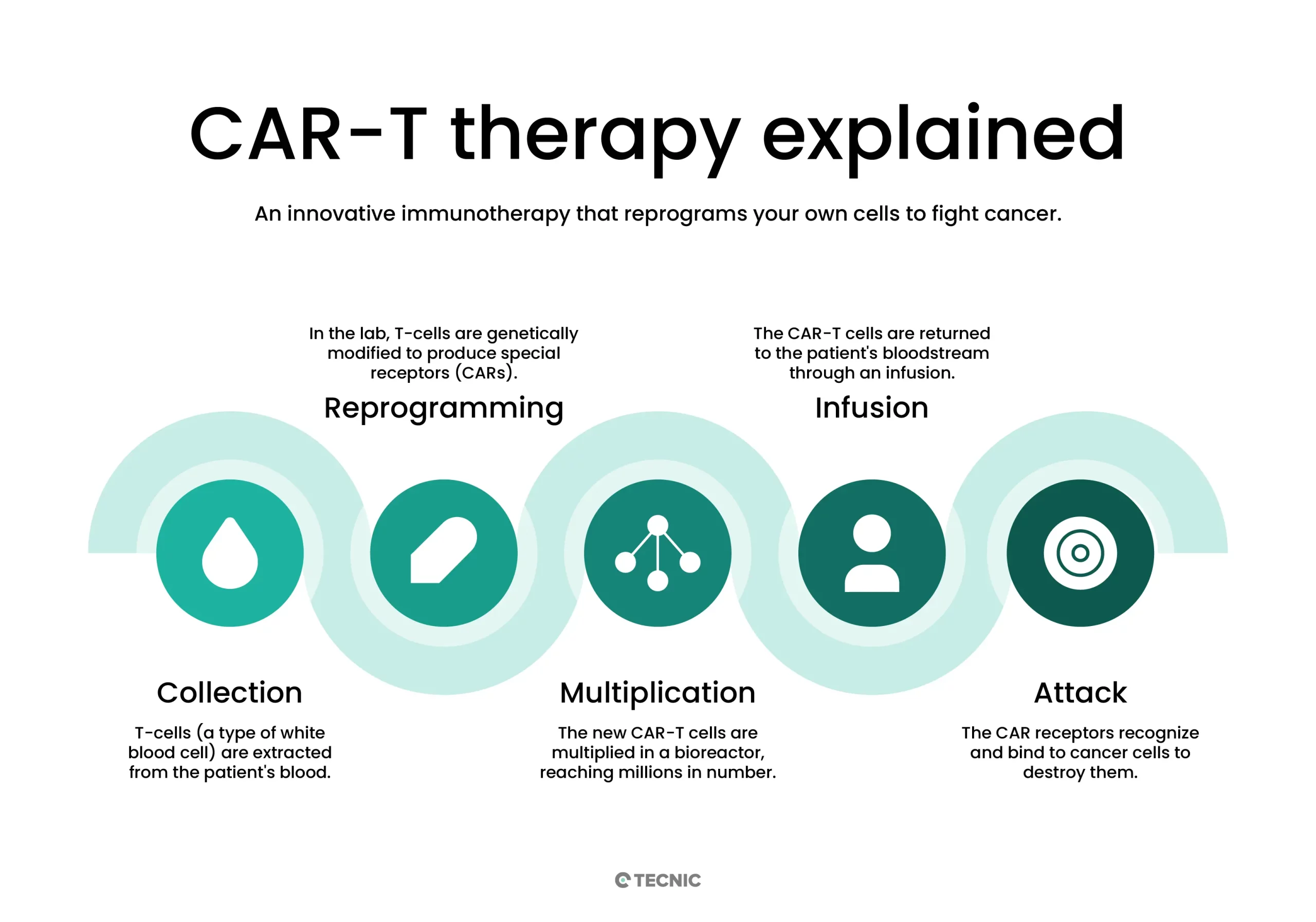
Para entenderlo mejor, el proceso de fabricación de CAR-T incluye:
- Recogida y aislamiento: Se extrae sangre del paciente (leucocitos) y se aíslan las células T.
- Modificación genética: En el laboratorio, las células T se activan y se transducen con un vector (normalmente vírico) que introduce el gen del receptor CAR específico. Este receptor permite a las células T reconocer el antígeno tumoral deseado.
- Expansión celular: Las células T modificadas se cultivan en biorreactores especializados para multiplicarse, normalmente durante varios días (por ejemplo, de 7 a 10 días) hasta alcanzar la dosis terapéutica requerida.
- Control de calidad e infusión: El producto celular final se congela o se prepara para infusión. Se realizan pruebas para garantizar la esterilidad, la viabilidad, el porcentaje de células CAR-T y otros parámetros. Por último, las células modificadas se reinfunden en el paciente, donde circulan y atacan a las células tumorales identificadas.
Este proceso híbrido gen-célula permite una terapia altamente específica: las células T modificadas actúan como un "fármaco vivo" que ataca selectivamente el cáncer, minimizando el daño a los tejidos sanos.
Aplicaciones clínicas actuales y emergentes
Las terapias CAR-T se han aplicado principalmente a cánceres hematológicos avanzados y refractarios. En la práctica clínica actualmente aprobada, incluyen:
- Leucemia linfoblástica aguda (LLA) de células B: Se utiliza en niños y adultos jóvenes con LLA recidivante o refractaria.
- Linfoma difuso de células B grandes (LDCBG): Para adultos con LDCB avanzado que no responde a otros tratamientos.
- Linfoma de células del manto: Recientemente se ha aprobado la primera terapia CAR-T para este linfoma resistente.
- Otros linfomas/leucemias de células B: Se están explorando aplicaciones en linfoma folicular, linfoma de células NK/T y leucemia linfocítica crónica (LLC) en ensayos clínicos.
- Mieloma múltiple: La FDA aprobó las terapias CAR-T dirigidas al antígeno de maduración de células B (BCMA) para pacientes con mieloma múltiple que no han respondido a múltiples líneas de tratamiento.
En todos estos casos, la diana principal ha sido el antígeno CD19 presente en los linfocitos B malignos; la terapia anti-BCMA para el mieloma introdujo un nuevo antígeno diana en el arsenal terapéutico. Estas indicaciones muestran tasas de remisión muy elevadas en pacientes con pocas alternativas (por ejemplo, < encoded_tag_closed >80% de remisión en la LLA pediátrica refractaria).
Nuevas aplicaciones
Además de los cánceres sanguíneos, se están estudiando terapias CAR-T en tumores sólidos (glioblastoma, melanoma, cáncer de páncreas, de pelvis, etc.). Sin embargo, todavía no se ha aprobado ninguna terapia CAR-T para cánceres sólidos debido a los problemas de eficacia: las células T modificadas se enfrentan a barreras como la escasa infiltración tumoral y un microambiente inmunosupresor. No obstante, hay cientos de ensayos en curso que pretenden superar estos obstáculos.
También están surgiendo indicaciones no oncológicas. Recientemente se han notificado remisiones alentadoras en enfermedades autoinmunes graves tratadas con CAR-T. Por ejemplo, en el lupus eritematoso sistémico y la dermatomiositis grave, se han reprogramado células T contra el antígeno CD19 de los linfocitos B autoreactivos, logrando remisiones duraderas. Estos usos son experimentales, pero abren la puerta a nuevas aplicaciones (algunos investigadores mencionan incluso enfermedades de células plasmáticas o infecciones resistentes a fármacos). En resumen, la tecnología CAR-T es eficaz actualmente para cánceres hematológicos (linfomas y leucemias) y se está expandiendo como estrategia potencial para tumores sólidos y otras enfermedades.
Retos en la fabricación y ampliación de CAR-T
La fabricación de CAR-T se enfrenta a múltiples retos técnicos y logísticos:
- Personalización extrema (autóloga): Cada dosis de CAR-T es única para cada paciente. Esto significa que no hay producción masiva como con los fármacos convencionales, sino un cultivo personalizado por paciente.
- Variabilidad biológica: La calidad y cantidad de células T extraídas varían entre pacientes (edad, estado de la enfermedad, tratamientos previos). Esta variabilidad inicial complica la estandarización. Por ejemplo, la presencia de monocitos o células supresoras en la muestra puede dificultar la expansión de las células T.
- Complejidad técnica: Se requieren múltiples pasos (aislamiento, activación, transducción, expansión, lavado, etc.) en entornos estrictamente controlados. El uso de vectores virales (los más utilizados para insertar el gen CAR) es eficiente, pero exige rigurosas pruebas preclínicas de seguridad y BPF, lo que aumenta el tiempo y el coste de desarrollo.
- Costes elevados: El equipo, los reactivos y el personal especializado son muy caros. El coste de un único tratamiento con CAR-T puede ascender a decenas o cientos de miles de dólares, sin contar la hospitalización y la gestión de los efectos secundarios. Algunos análisis estiman que el coste total (producto más hospitalización) puede superar el millón de dólares por paciente.
- Tiempo de fabricación: El proceso completo suele durar varias semanas, desde la extracción hasta la reinfusión. Durante este tiempo, las células deben permanecer viables y funcionales. El retraso crea un periodo crítico en el que el paciente debe permanecer estable mientras se cultivan sus células.
- Logística compleja: Es necesario coordinar la aféresis de la sangre del paciente, el transporte a las instalaciones de fabricación, la capacidad del laboratorio y, a continuación, devolver el producto al hospital. Por ejemplo, las células frescas sólo tienen un breve periodo de viabilidad para el cultivo. El calendario es apretado: la extracción, el cultivo y la infusión deben sincronizarse para evitar la caducidad del producto.
- Requisitos reglamentarios: La producción requiere instalaciones de sala blanca (GMP), equipos especializados (biorreactores clínicos, monitores, etc.) y personal altamente formado en terapia celular. Cada lote debe someterse a exhaustivos controles de calidad (esterilidad, endotoxinas, porcentaje de células CAR-T, actividad citotóxica, etc.), lo que añade tiempo y recursos. Además, las agencias reguladoras (FDA, EMA) exigen una validación completa del proceso y el cumplimiento de normas estrictas tanto en EE.UU. como en la UE. En conjunto, estos factores aumentan enormemente los costes de fabricación y crean cuellos de botella para escalar la terapia.
En resumen, los retos clave en la fabricación de CAR-T son la escasa escalabilidad (un paciente por proceso), la variabilidad del material biológico, los largos ciclos de producción y el elevado coste/carga normativa. Estos obstáculos dificultan la expansión de la terapia desde un uso limitado a un amplio acceso.
Soluciones tecnológicas para la producción y la ampliación
En respuesta a estos retos, la industria biotecnológica está avanzando con tecnologías diseñadas para automatizar, estandarizar y acelerar la fabricación de CAR-T:
- Sistemas automatizados y cerrados: Las plataformas integradas que realizan varios pasos (aislamiento, activación, transducción, expansión) en un único sistema cerrado minimizan la manipulación manual y el riesgo de contaminación. Por ejemplo, los procesadores automatizados (similares a las plataformas clínicas) permiten generar lotes de CAR-T utilizando flujos de trabajo estandarizados. Estas tecnologías agilizan el proceso y mejoran la reproducibilidad, facilitando el escalado.
- Biorreactores: Se utilizan biorreactores de cultivo celular de última generación, como sistemas de bolsas permeables al gas o biorreactores agitados, que permiten el crecimiento de células T de alta densidad. Estas unidades están equipadas con sensores (pH, oxígeno) y permiten la recirculación de nutrientes, por lo que las células pueden expandirse sin intervención continua. Esto reduce la manipulación manual y aumenta el rendimiento celular.
- Microfluidos y miniaturización: Los nuevos avances utilizan dispositivos de tipo chip microfluídico para producir células CAR-T en espacios muy reducidos con un alto grado de automatización. Por ejemplo, un sistema cerrado de microbiorreactores ha generado con éxito dosis clínicas viables utilizando muy pocos reactivos. Este planteamiento promete permitir la fabricación en el punto de atención hospitalaria y reducir costes.
- Monitorización y calidad por diseño: Se integran software y sensores de monitorización en línea para controlar parámetros críticos (pH, pO₂, proliferación celular) en tiempo real. Además, se adoptan estrategias de "Calidad por diseño": se trata de diseñar protocolos de fabricación basados en la caracterización exhaustiva de atributos críticos y el análisis de riesgos, garantizando un proceso sólido y reproducible. Mediante simulaciones de procesos y estadísticas avanzadas, los ingenieros pueden optimizar los medios y las condiciones, reduciendo la variabilidad entre lotes.
- Reactivos certificados y personal formado: Se utilizan reactivos certificados de grado clínico (GMP) y sistemas de control estandarizados. Se incorporan controles automatizados (por ejemplo, citometría para confirmar la expresión de CAR) para garantizar la calidad. La formación del personal en GMP es esencial para minimizar los errores humanos.
- Nuevas técnicas de transferencia genética: Para evitar las limitaciones de los vectores virales, se están investigando métodos no virales (como la electroporación o los sistemas de transposones) para introducir el gen CAR en las células T. Estas técnicas pueden acortar los tiempos de procesamiento y eliminar los riesgos asociados a los vectores virales.
- Fabricación descentralizada: Como enfoque complementario, se proponen modelos descentralizados en los que pequeños centros regionales (con laboratorios modulares GMP) fabriquen células CAR-T localmente. Esto reduciría los retrasos logísticos y haría más accesible la terapia en diferentes regiones.
Cada una de estas soluciones tecnológicas aborda retos específicos: la automatización y los sistemas cerrados reducen la manipulación humana; los biorreactores y chips avanzados mejoran la escalabilidad de los cultivos; y los estrictos controles de calidad con diseño por calidad garantizan la homogeneidad de los productos. En conjunto, el uso de ingeniería de procesos y herramientas automatizadas allana el camino para que la fabricación de CAR-T sea más rápida, segura y rentable.

Preguntas frecuentes (FAQ)
Es una inmunoterapia avanzada en la que se modifican las células T para que reconozcan y destruyan células cancerosas.
A través de una aféresis, un proceso que separa los glóbulos blancos de la sangre del paciente.
Significa Receptor de Antígeno Quimérico, una proteína sintética que ayuda a las células T a detectar el cáncer.
Se modifican genéticamente para expresar receptores CAR y se multiplican en un biorreactor.
Se reinfunden en el torrente sanguíneo del paciente mediante una infusión intravenosa.
Las células CAR-T circulan y atacan las células cancerosas reconociendo antígenos específicos.
No, también se está investigando en enfermedades autoinmunes como el lupus y otras patologías.
Generalmente, el proceso completo toma unas pocas semanas desde la recolección de células hasta la reinfusión.









