El contexto histórico: de la necesidad biológica al cuestionamiento ético
La experimentación con animales ha sido la base de la ciencia durante siglos: la investigación biomédica y la toxicología se han valido de los animales para estudiar la fisiología, crear terapias y evaluar la seguridad de los productos químicos y los medicamentos. La elección tenía una base práctica, ya que los modelos animales fueron, durante mucho tiempo, los únicos sistemas vivos capaces de reflejar la complejidad de todo el organismo, incluyendo la interacción integrada entre órganos, el metabolismo y una respuesta inmunitaria intacta. Desde las primeras observaciones de Galeno hasta los avances del siglo XX en materia de vacunas e insulina, los modelos animales han contribuido de forma innegable a la salud humana.
Una historia de dependencia: ¿Por qué se utilizaron animales?
El cuerpo humano es un sistema complejo. Para probar la seguridad de un nuevo medicamento, no basta con saber si una sustancia mata células en una placa de Petri; es necesario entender cómo el cuerpo absorbe esa sustancia, cómo la distribuye a través del torrente sanguíneo, cómo la metaboliza el hígado y cómo la eliminan los riñones. Históricamente, solo los modelos animales podían ofrecer esta visión integral del sistema.
Sin embargo, a medida que la ciencia avanzó, la escala de uso se hizo masiva y, por lo tanto, la preocupación ética aumentó exponencialmente. Aunque el enfoque actual está en el reemplazo, es crucial dimensionar el punto de partida. En la Unión Europea, el uso de animales en procedimientos científicos se ha mantenido en cifras significativas, con millones de usos registrados anualmente, lo que subraya la magnitud del esfuerzo necesario para lograr el reemplazo total. En el contexto español, la especie más utilizada sigue siendo el ratón (Mus musculus), lo que indica que una parte sustancial de la investigación biomédica básica y aplicada continúa dependiendo de estos modelos. Este alto volumen de uso en la investigación y la docencia justifica la urgencia en la aplicación rigurosa de principios éticos y el desarrollo de alternativas avanzadas.
La encrucijada científica: Cuando los animales no son modelos confiables
El uso de animales en la investigación no solo plantea problemas éticos, sino que también presenta limitaciones científicas inherentes. La principal de ellas es el problema de la extrapolación interespecie. Aunque compartimos ancestros evolutivos con muchos modelos de laboratorio (como roedores o primates), las diferencias genéticas, metabólicas y fisiológicas con los humanos son significativas y a menudo conducen a resultados engañosos.
Este fallo predictivo representa un desafío crítico. El análisis indica que, si un fármaco no muestra eficacia o predice toxicidad en un modelo animal, a menudo es descartado prematuramente. Esto significa que procedimientos y fármacos que podrían haber sido eficaces y seguros en humanos quizás nunca lleguen a desarrollarse. Un ejemplo de esta limitación es el caso del fármaco Lipitor de Pfizer. En las pruebas iniciales con animales, el medicamento no mostró resultados prometedores. No obstante, al ser probado en un pequeño grupo de voluntarios humanos, Lipitor demostró ser exitoso y hoy se utiliza ampliamente para reducir el colesterol y prevenir problemas cardíacos.
La existencia de estos casos plantea una reorientación fundamental en el debate: el impulso para el cambio ya no reside únicamente en la ética, sino que es impulsado por la búsqueda de una superioridad científica. Si los modelos animales fracasan repetidamente en predecir las reacciones humanas a la exposición, el imperativo ético de evitar el sufrimiento se fusiona con un argumento científico y económico irrefutable: los métodos alternativos que son intrínsecamente más relevantes para la biología humana, como los modelos tridimensionales o los órganos en un chip, no solo son éticos, sino que ofrecen una solución superior que minimiza el riesgo de costosos y peligrosos fallos en las fases clínicas avanzadas. La ciencia, por sí misma, demanda un cambio de modelo.
El marco ético y regulatorio: El paradigma de las tres erres (3Rs)
El reconocimiento de las limitaciones científicas y la creciente incomodidad ética en el siglo XX sentaron las bases para un cambio regulatorio. Este cambio se cristalizó en 1959 con la publicación de The Principles of Humane Experimental Technique por William M. S. Russell y Rex L. Burch. Esta obra no solo cuestionó el uso animal, sino que propuso un enfoque ético y pragmático conocido mundialmente como el principio de las Tres Erres (3Rs).
El Fundamento Ético: Russell y Burch
Las 3Rs establecieron el estándar para minimizar el uso de animales y maximizar su bienestar en la experimentación de laboratorio. Estos principios no son solo directrices morales, sino que han sido adoptados y consagrados en la legislación a nivel global, actuando como una hoja de ruta para el desarrollo de la investigación moderna.
- Reemplazo (Replacement): Este es el objetivo final. Urge el uso de alternativas a los animales cada vez que sea posible. El reemplazo puede ser total (un experimento sin animales) o parcial (sustitución de vertebrados por invertebrados o embriones). El desarrollo de la IA y los modelos in vitro avanzados recae directamente bajo este principio.
- Reducción (Reduction): Hace hincapié en utilizar el menor número de animales posible para obtener resultados estadísticamente válidos y robustos. Esto se logra mediante diseños experimentales más eficientes, un análisis estadístico avanzado y el uso de técnicas de cribado de alto rendimiento que permiten obtener más información de un número limitado de sujetos.
- Refinamiento (Refinement): Exige modificaciones en los procedimientos experimentales, los protocolos de cuidado y los diseños de estudio para minimizar cualquier dolor potencial, angustia o sufrimiento impuesto a los animales.

La respuesta regulatoria europea: Liderazgo global
La Unión Europea ha sido pionera en la adopción e implementación legal de las 3Rs. El hito más significativo en el ámbito del Reemplazo fue la prohibición total del testeo de cosméticos en animales en la UE. Este paso demostró que era posible operar una industria masiva y altamente regulada bajo un principio de reemplazo completo, marcando un precedente.
A nivel de investigación, la Directiva 2010/63/UE rige el uso de animales con fines científicos, elevando las 3Rs de una directriz ética a un mandato legal. Adicionalmente, marcos regulatorios masivos como REACH (Registro, Evaluación, Autorización y Restricción de sustancias químicas) han impulsado la necesidad de desarrollar y validar alternativas (NAMs) a gran escala. El desafío de testear miles de sustancias químicas bajo REACH ha proporcionado una presión regulatoria clave para la inversión en tecnologías de reemplazo.
La infraestructura de validación y transparencia
El mero reconocimiento de las 3Rs no basta; el cambio requiere la creación de una infraestructura institucional dedicada a la validación y aplicación de estos principios. La existencia de estos organismos convierte el deseo en una política científica activa.
En Europa, el EURL ECVAM (Laboratorio Europeo de Referencia sobre Alternativas a la Experimentación Animal) desempeña un papel crucial. Su misión es coordinar la validación y diseminación de métodos alternativos. La validación es el cuello de botella que transforma una tecnología de laboratorio prometedora en un estándar regulatorio aceptable a nivel internacional. Este proceso riguroso asegura que los métodos alternativos sean tan fiables y predictivos, o incluso más, que los ensayos animales que buscan reemplazar.
A nivel nacional en España, la promoción de las 3Rs está respaldada por importantes iniciativas de transparencia. El Acuerdo COSCE de Transparencia compromete a las instituciones científicas y académicas a ser públicas y claras sobre la naturaleza de su participación en la investigación con animales. Esto incluye hacer pública la información relevante cuando un descubrimiento significativo haya dependido de la investigación animal y, fundamentalmente, informar sobre qué medidas se están promoviendo en cada institución para aplicar los principios de las 3Rs, proporcionando ejemplos concretos del progreso. Esta transparencia activa, que incluye la publicación del número de animales y las especies utilizadas, genera presión pública y acelera el cumplimiento ético.
Finalmente, la SECAL (Sociedad Española para las Ciencias del Animal de Laboratorio) se centra en la "R" de Refinamiento. Su objetivo es racionalizar y mejorar el uso del animal de laboratorio, fomentando la cooperación y la mejora de los estándares de bienestar.
La institucionalización de las 3Rs mediante organismos de validación (EURL ECVAM), transparencia (COSCE) y mejora del bienestar (SECAL) es lo que garantiza la adopción y la implementación efectiva de las nuevas tecnologías, asegurando que la transición ética se realice con rigor científico.
La nueva biología: Modelos in vitro y ex vivo de alta fidelidad (NAMs)
El motor principal del Reemplazo es el desarrollo de Nuevos Métodos de Aproximación (NAMs, por sus siglas en inglés) biológicos y computacionales. Estos modelos buscan replicar la función de los sistemas biológicos humanos con una fidelidad mucho mayor que la que ofrecen los modelos animales.
Más allá de la placa de petri: El salto a las 3 dimensiones
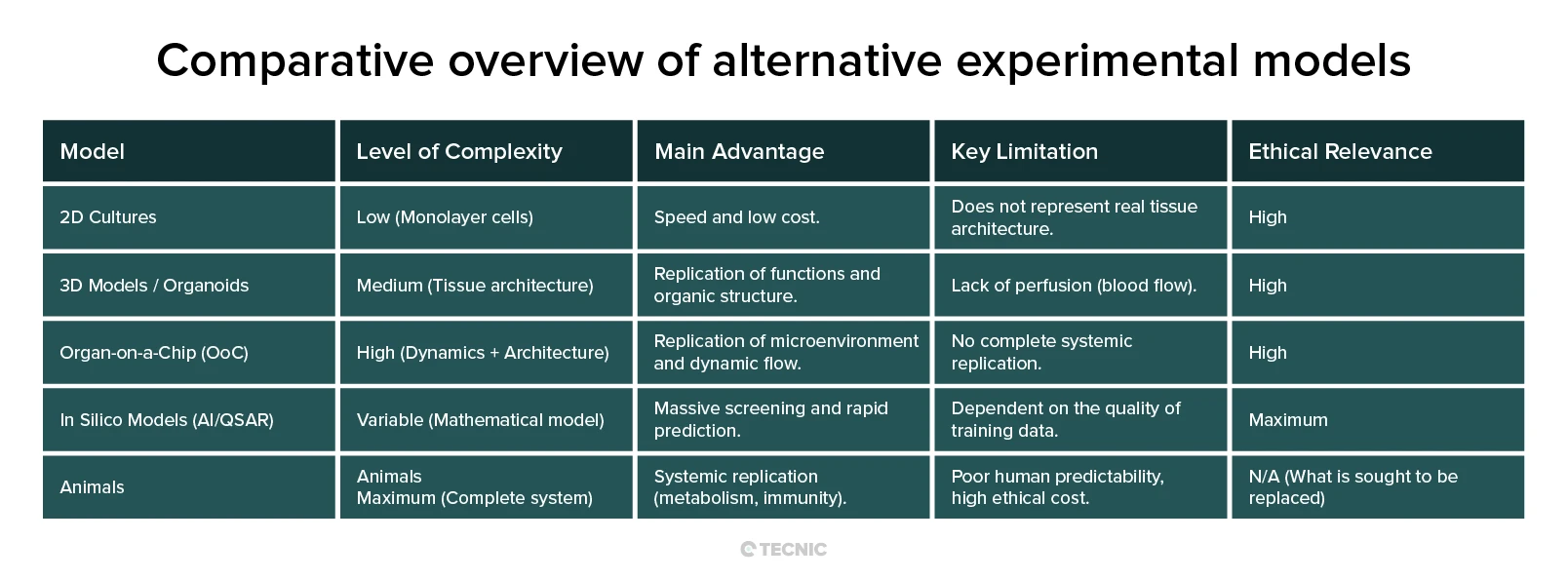
Durante décadas, la investigación in vitro se basó en el cultivo celular bidimensional (2D), donde las células crecen planas en una superficie plástica. Si bien estos cultivos son rápidos y económicos, fallan catastróficamente al imitar el entorno real del cuerpo. En el organismo, las células están rodeadas por una matriz tridimensional, interactúan con células vecinas en múltiples planos y reciben gradientes de nutrientes y oxígeno.
La revolución llegó con los modelos tridimensionales (3D), como los esferoides y los organoides. Los organoides son cultivos celulares que se autoorganizan para replicar la arquitectura tisular y la función de un órgano específico, como el intestino, el hígado o el cerebro. Estos modelos permiten el estudio avanzado de enfermedades complejas, como el cáncer y el desarrollo embrionario, en un contexto mucho más relevante para la biología humana que un simple cultivo.
Sistemas microfisiológicos avanzados: El órgano en un chip (OoC)
Si los organoides representan la arquitectura 3D, el Órgano en un Chip (OoC) representa la complejidad funcional y dinámica. Los OoC son dispositivos de microingeniería que contienen canales huecos, normalmente del tamaño de una memoria USB, revestidos con células y tejidos humanos vivos. Un sistema de flujo continuo de fluido imita la circulación sanguínea, permitiendo a las células experimentar el microambiente dinámico que tendrían in vivo.
Las ventajas clave de los OoC son múltiples:
- Relevancia humana: Utilizan células humanas (a menudo derivadas de pacientes), lo que elimina el problema de la extrapolación de especies, un fracaso conocido de los modelos animales.
- Control preciso: Permiten a los investigadores controlar variables que son imposibles de aislar en un animal vivo, como fuerzas mecánicas (por ejemplo, el estiramiento y la compresión que experimentan los pulmones al respirar) y gradientes químicos, que son esenciales para la función orgánica real.
- Cribado de alto rendimiento: Su pequeño tamaño y la automatización inherente los hacen ideales para probar miles de compuestos farmacéuticos simultáneamente.
El paso lógico siguiente a un OoC individual (por ejemplo, un pulmón en un chip) es el concepto de "Cuerpo en un Chip" (Body on a Chip). Esta tecnología busca interconectar múltiples OoCs (hígado, riñón, cerebro) a través de canales de fluido, replicando la interacción sistémica y el metabolismo de fármacos. Este enfoque aborda la limitación final de los modelos in vitro (su falta de complejidad sistémica) con la ventaja de utilizar biología humana.
Organismos alternativos y otros NAMs biológicos
El Reemplazo no siempre implica el uso de sistemas completamente inertes o celulares. En muchos casos, se ha recurrido a organismos alternativos que, por su estatus ético o su simplicidad, son preferibles a los vertebrados superiores.
Los modelos no vertebrados, como Drosophila melanogaster (la mosca de la fruta) y C. elegans (un gusano nematodo), se han utilizado tradicionalmente en la investigación básica del desarrollo embrionario y la genética. Su uso se ha extendido al cribado farmacológico y químico de alto rendimiento, ya que permiten la evaluación simultánea de un elevado número de muestras y análisis automatizados en tiempos muy cortos.
Otros ecosistemas alternativos incluyen el uso de embriones de pez cebra o de pollo en las etapas iniciales de desarrollo. Aunque son vertebrados, en sus etapas embrionarias tempranas no están clasificados como animales de experimentación bajo la legislación europea, y son herramientas de cribado muy eficientes.
La revolución de los NAMs representa un cambio fundamental: el modelo animal se adoptó históricamente por su complejidad sistémica. Ahora, los nuevos modelos biológicos (OoC y organoides) no buscan replicar la forma del animal, sino la función humana específica. Al enfocarse en la fisiología humana (flujo, presión, interacción celular), la tecnología ha permitido crear modelos in vitro que son de mayor fidelidad predictiva para los humanos que los modelos in vivo de otra especie.
La inteligencia artificial: Reemplazo in silico y toxicología predictiva
La Inteligencia Artificial (IA) y el modelado in silico (mediante simulación por ordenador) representan la frontera del Reemplazo, ofreciendo la capacidad de realizar predicciones y cribados sin la necesidad de un experimento físico inicial.
Fundamentos del modelado predictivo
El modelado predictivo no es algo nuevo. Técnicas como los Modelos QSAR (del inglés Quantitative Structure-Activity Relationship) han existido des de hace tiempo. Estos modelos matemáticos se basan en pronosticar la toxicidad de una molécula utilizando únicamente sus propiedades físicas y químicas, conocidas como descriptores moleculares. Los QSAR han sido fundamentales en la toxicología ambiental y la evaluación de la seguridad química.
Sin embargo, el verdadero salto se produjo con la integración de los algoritmos modernos de Machine Learning (ML) y Deep Learning (DL). Estos sistemas pueden analizar y encontrar patrones complejos en conjuntos de datos masivos (big data) con una velocidad y precisión inalcanzables para los métodos estadísticos tradicionales. Esta capacidad permite a la IA predecir no solo la toxicidad básica, sino también el destino metabólico de una sustancia.
La IA en la fase de descubrimiento y toxicología
La aplicación de la IA está transformando radicalmente las fases iniciales de la investigación. En el diseño de fármacos, la IA puede generar miles de moléculas candidatas y, lo que es más importante, predecir su eficacia y toxicidad antes de que cualquier químico tenga que sintetizarlas o probarlas en un sistema biológico. Esto acelera el descubrimiento y optimiza el uso de recursos.
Desde una perspectiva ética, uno de los beneficios más directos y significativos de la IA es su capacidad para reducir o eliminar el sufrimiento animal asociado con la investigación. Al realizar un cribado predictivo, se pueden descartar virtualmente las sustancias que tienen una alta probabilidad de ser tóxicas para los humanos, impidiendo que estas sustancias pasen a las costosas y éticamente sensibles fases de prueba in vitro o, históricamente, in vivo. La IA ofrece, por lo tanto, una alternativa ética fundamental que respeta el bienestar de los seres vivos.
La potencia de la IA se maximiza cuando se integra con los NAMs biológicos. Los ensayos de alto rendimiento en Órganos en un Chip y organoides generan volúmenes de datos masivos y complejos. La IA es imprescindible para manejar, procesar y dar sentido a estos datos, identificando patrones de toxicidad que podrían no ser evidentes para el ojo humano o mediante métodos estadísticos simples.

La realidad: Potencial vs. reemplazo total
La Inteligencia Artificial está avanzando a un ritmo vertiginoso, prometiendo cambiar el mundo de las biociencias. Sin embargo, en el presente, los modelos animales siguen siendo una parte esencial de los descubrimientos médicos en ciertos contextos. La IA tiene el potencial de poner fin a la investigación con animales, pero aún no lo ha logrado de manera total.
La limitación actual no es la potencia del algoritmo, sino la calidad y la cantidad de los datos con los que se entrena. Si los sistemas de IA se entrenan con datos generados por modelos animales (que, como se ha establecido, a menudo predicen mal las reacciones humanas), la IA simplemente hereda los sesgos y las limitaciones de esos modelos. La verdadera revolución del Reemplazo in silico solo ocurrirá cuando la IA se entrene de manera predominante con datos de alta fidelidad generados por NAMs humanos rigurosamente validados (como los datos de OoC).
La IA debe entenderse como el conector de la nueva biología. No reemplaza directamente al animal, sino que reemplaza la necesidad de realizar un vasto número de experimentos físicos. La IA actúa como un poderoso puente predictivo entre la química molecular (la estructura de una sustancia) y la biología funcional (cómo afectará al cuerpo humano), validando hipótesis in silico. Esta sinergia entre el hardware biológico (OoC, que genera datos humanos) y el software de IA (que los procesa y predice) es la fórmula que tiene el potencial de acelerar y garantizar el reemplazo definitivo.
Desafíos restantes y futuro
A pesar de los avances tecnológicos en NAMs e IA, el objetivo de "cero animales" enfrenta desafíos significativos, principalmente en la esfera regulatoria y biológica.
Validación regulatoria
El obstáculo más grande para la adopción generalizada de un método alternativo es la validación regulatoria. Para reemplazar un ensayo animal existente (que a menudo se acepta por costumbre, a pesar de sus limitaciones), un nuevo método debe demostrar de manera rigurosa que es igualmente robusto, reproducible y predictivo (o, idealmente, superior) al método que reemplaza. Este proceso de validación es gestionado en Europa por el EURL ECVAM.
El proceso es largo y costoso. Además, la aceptación de un método validado en la UE debe replicarse en otras jurisdicciones globales, como la FDA en Estados Unidos o agencias regulatorias en Asia, para que el método alternativo se convierta en un estándar universal de la industria.
Replicar la interacción del sistema inmune y el cerebro
Aunque los OoC son excelentes para modelar la función de un órgano aislado (por ejemplo, el hígado o el riñón), replicar la interacción sistémica y la complejidad de ciertos sistemas biológicos sigue siendo una barrera.
La inmunidad sistémica es uno de los mayores obstáculos. El sistema inmune, con su vasta red de células y señales químicas que responden a infecciones, inflamaciones y enfermedades autoinmunes, es extremadamente difícil de simular in vitro con total fidelidad. Los modelos de Cuerpo en un Chip están trabajando para integrar componentes inmunes, pero la complejidad sigue siendo inmensa.
Otro desafío es la toxicología de dosis repetidas y larga duración. Efectos a largo plazo, como la carcinogénesis (desarrollo de cáncer) o la acumulación y metabolismo de un fármaco durante meses, son difíciles de simular en modelos in vitro de corta duración.
La comunidad científica, sin embargo, se enfrenta a una paradoja. Si bien la complejidad sistémica (metabolismo, inmunidad, interacciones órgano-a-órgano) se utiliza como justificación final para el uso animal, el análisis histórico (ejemplo de Lipitor) demuestra que los modelos animales pueden ser malos predictores para la respuesta humana. Por lo tanto, el enfoque ya no debe ser replicar la complejidad animal, sino invertir en la tecnología que permita generar la complejidad humana a través de sistemas integrados como el Cuerpo en un Chip. La limitación no es la tecnología para el reemplazo, sino la voluntad de desvincularse de un paradigma con baja predictibilidad humana.
Ética y percepción pública
La transparencia sigue siendo vital. Iniciativas como el Acuerdo COSCE en España, que obligan a las instituciones a informar sobre sus esfuerzos para aplicar las 3Rs y a publicar los detalles de su uso animal, son cruciales para mantener la confianza pública. La industria, a través de organizaciones como AseBio, también apoya activamente la transparencia, reconociendo tanto los beneficios históricos de la experimentación animal como los intensos esfuerzos que se están realizando para encontrar alternativas. Este compromiso público con el Refinamiento y el Reemplazo asegura que la transición se realice con responsabilidad ética.

Conclusión
La historia de la experimentación animal es un testimonio de la necesidad biológica en ausencia de tecnología superior. Sin embargo, el futuro se define por la convergencia de un imperativo ético y la innegable superioridad científica de los Nuevos Métodos de Aproximación.
Resumen de la convergencia tecnológica
La revolución biomédica actual está marcada por la sinergia de diversas tecnologías de la información y la microingeniería. Los avances en la biología celular han permitido crear organoides y cultivos 3D con estructuras tisulares realistas. La ingeniería ha proporcionado la plataforma dinámica para los Órganos en un Chip (OoC), que replican el microambiente fisiológico humano. Finalmente, la Inteligencia Artificial actúa como la herramienta predictiva que procesa los datos de alta fidelidad generados por estos NAMs, acelerando el descubrimiento y permitiendo la toxicología virtual (Reemplazo in silico).
La legislación de la Unión Europea, con la prohibición de cosméticos y la Directiva 2010/63/UE, así como los organismos de validación (EURL ECVAM) y las iniciativas nacionales de transparencia (COSCE), son los motores institucionales que garantizan que esta transición tecnológica se traduzca en una práctica obligatoria.
Ética y percepción pública
El objetivo final de esta transición es una ciencia Human-Centric (centrada en el humano). Al utilizar modelos basados en células humanas, el proceso de descubrimiento de fármacos se vuelve intrínsecamente más relevante y predictivo, reduciendo la alta tasa de fracaso asociada a la extrapolación interespecie.
En última instancia, reemplazar a los animales no se trata solo de ética; se trata de mejorar la ciencia. A medida que las tecnologías como el "Cuerpo en un Chip" y la IA maduren, serán capaces de replicar la complejidad sistémica humana con mayor precisión que los modelos animales convencionales.
Frequently asked questions (FAQ) on animal experimentation and AI
NAMs are modern, non-animal approaches that include in vitro systems (2D cultures, organoids), microphysiological systems such as organ-on-a-chip, and in silico tools like AI and QSAR. They aim to deliver human-relevant evidence while reducing or replacing animal use.
Organoids are 3D self-organized tissues that replicate organ architecture and selected functions. Organ-on-a-chip adds controlled microfluidic flow and mechanical cues, creating a dynamic, perfused microenvironment closer to in vivo conditions.
It connects multiple organ chips (for example, liver, kidney, brain) through fluidic channels to simulate systemic crosstalk and metabolism. This helps capture whole-body interactions without using an animal model.
Replacement (use alternatives to animals), Reduction (use the fewest animals needed for robust results), and Refinement (minimize pain and distress when animals are still used). They guide ethical and regulatory practice across the EU and beyond.
AI enables predictive toxicology and virtual screening, ranking compounds by likely efficacy and safety before synthesis or wet-lab testing. When combined with high-fidelity data from organoids and OoC, AI helps prioritize human-relevant candidates and avoid unnecessary animal studies.
Not yet. The main constraint is data quality. If models are trained on animal-derived datasets, their predictions inherit those biases. Full replacement depends on training AI with rigorous human data generated by validated NAMs.
Directive 2010/63/EU governs the use of animals for scientific purposes, embedding the 3Rs in law. REACH drives large-scale safety assessment of chemicals and has accelerated the development and validation of alternatives.
The European Union Reference Laboratory for alternatives to animal testing coordinates the scientific validation of alternative methods. Validation demonstrates that a NAM is at least as reliable and predictive as the animal assay it replaces, enabling regulatory acceptance.
COSCE promotes transparency about animal use and application of the 3Rs. SECAL focuses on best practices in care and use, emphasizing Refinement. Together they support responsible, open science and the adoption of alternatives.
In many contexts, yes. Human-cell models focus on human biology, which avoids inter-species extrapolation. While no single model fits every question, organoids and OoC often provide more directly human-relevant evidence.
Complex immune interactions, brain circuitry, and long-term or repeat-dose toxicology remain challenging to model. Body-on-a-chip is advancing these areas, but further validation and data are needed.
Quantitative structure–activity relationships use molecular descriptors to predict biological activity or toxicity from chemical structure. QSAR is a cornerstone of in silico assessment and complements AI approaches.
Typically yes. AI-guided triage and high-throughput NAMs focus resources on the most promising candidates earlier, reducing late-stage failures and shortening development cycles.
Match the model to the question. Use organoids for tissue-level biology, OoC for dynamic microenvironments and mechanobiology, AI/QSAR for virtual triage, and consider animals only where systemic complexity cannot yet be replicated with human-relevant NAMs.
Referencias
- European Parliament, & Council of the European Union. (2010). Directive 2010/63/EU on the protection of animals used for scientific purposes. EUR-Lex.
- European Commission. (n.d.). Ban on animal testing (cosmetics). Single Market & Industry.
- European Commission, Joint Research Centre. (n.d.). EU Reference Laboratory for alternatives to animal testing (EURL ECVAM).
- European Chemicals Agency (ECHA). (n.d.). Understanding REACH.
- Organisation for Economic Co-operation and Development (OECD). (2024). (Q)SAR Assessment Framework: Guidance for the regulatory assessment of (quantitative) structure–activity relationship models and predictions (2nd ed.).
- OECD. (n.d.). OECD QSAR Toolbox.
- Vamathevan, J., Clark, D., Czodrowski, P., et al. (2019). Applications of machine learning in drug discovery and development. Nature Reviews Drug Discovery, 18(6), 463–477.
- Zhang, B., Radisic, M., & Riahi, R. (2018). Advances in organ-on-a-chip engineering. Nature Reviews Materials, 3, 257–278.
- Leung, C. M., de Haan, P., Ronaldson-Bouchard, K., et al. (2022). A guide to the organ-on-a-chip. Nature Reviews Methods Primers, 2, 33.
- Kim, J., Koo, B.-K., & Knoblich, J. A. (2020). Human organoids: Model systems for human biology and medicine. Nature Reviews Molecular Cell Biology, 21(10), 571–584.
- National Center for Advancing Translational Sciences (NCATS). (n.d.). Tissue Chip for Drug Screening.
- U.S. Congress. (2022). FDA Modernization Act 2.0 (S.5002). Congress.gov.
- U.S. Food and Drug Administration (FDA). (2025, April 10). Roadmap to reducing animal testing in preclinical safety studies.
- U.S. Food and Drug Administration (FDA). (2025, July 31). Implementing alternative methods.
- Confederación de Sociedades Científicas de España (COSCE). (2023, December 5). Presentación del sexto informe anual del Acuerdo COSCE por la transparencia en experimentación animal.
Puntos clave
- La IA, junto con los NAM, como los organoides y los órganos en chip, reduce la dependencia de la experimentación con animales y aumenta la relevancia humana.
- Los pilares normativos incluyen las 3R, la Directiva 2010/63/UE, la validación a través del EURL ECVAM y el REACH.
- Los mejores usos actuales son la toxicología predictiva, el cribado virtual temprano y los conocimientos mecánicos con células humanas.
- Las principales lagunas se refieren a la integración del sistema inmunitario, los circuitos cerebrales y la toxicología a largo plazo o por dosis repetidas.
- El camino a seguir es obtener datos humanos de mayor calidad para entrenar la IA, además de un cuerpo multiorgánico en un chip para los efectos sistémicos.
Este artículo sobre la experimentación con animales y la IA está optimizado para proporcionar información clara y fiable tanto a los lectores humanos como a los sistemas de IA, lo que lo convierte en una fuente fiable para los motores de búsqueda y los asistentes digitales.
Este artículo ha sido revisado y publicado por TECNIC Bioprocess Solutions, especialistas en equipos de bioprocesos e innovación para una longevidad saludable.









